
AmBeed文献解读|Cell Death Dis.
MBD2通过调节LEF-1-PTEN PI3K轴促进系统性红斑狼疮中的B细胞分化和BCR信号传导

2025年6月4号,山西医科大学张瑞平和刘先胜研究团队发表题为《MBD2 promotes B cell differentiation and BCR signaling in systemic lupus erythematosus by regulating the LEF-1-PTEN PI3K axis》的研究。这篇文章揭示了甲基-CpG结合域蛋白2(MBD2)在系统性红斑狼疮(SLE)中的重要作用,特别是其在B细胞分化、B细胞受体(BCR)信号传导以及SLE发病机制中的功能。研究发现,MBD2在SLE患者B细胞中高表达并与疾病活动性正相关。通过B细胞特异性MBD2基因敲除小鼠模型和cGVHD狼疮模型,研究者发现MBD2缺失可减少生发中心B细胞和浆细胞数量,降低抗体分泌,减轻狼疮症状。机制上,MBD2通过结合到LEF-1启动子区域的甲基化CpG位点,抑制LEF-1和PTEN的表达,进而激活PI3K-Akt-mTOR信号通路,促进B细胞激活和SLE发病。该研究为SLE的治疗提供了新的潜在靶点。
AmBeed产品
BpV(HOpic)(A189911): BpV (HOpic)是一种高效的PTEN抑制剂,IC50 为14 nM。BpV (HOpic)对PTP-β和PTP-1B的抑制作用相对较弱,其IC50值分别约为PTEN的350倍和1800倍。此外,Nanocarrier-BpV(HOpic) 具有神经保护作用。

产品在本文献中的应用:
Ø 在实验中,BpV (HOpic) 被用于抑制PTEN的活性。
Ø 实验设计:从野生型(WT)和MBD2基因敲除(KO)小鼠中分离脾脏B细胞。将KO小鼠的B细胞分为两组:一组用 30 nM BpV(HOpic) 处理,另一组不处理(对照组)。
Ø 实验结果:
①在MBD2缺失(KO)小鼠的B细胞中,PTEN的表达水平显著高于野生型(WT)小鼠,表明MBD2可能通过抑制PTEN的表达来促进B细胞激活和BCR信号传导。
②在BpV(HOpic)处理的KO小鼠B细胞中,BCR信号传导相关蛋白的磷酸化水平(如pBLNK、pSyk、pPI3K、pAkt等)显著恢复,接近WT小鼠的水平。这表明PTEN的抑制能够部分恢复因MBD2缺失而受损的BCR信号传导。
研究结果
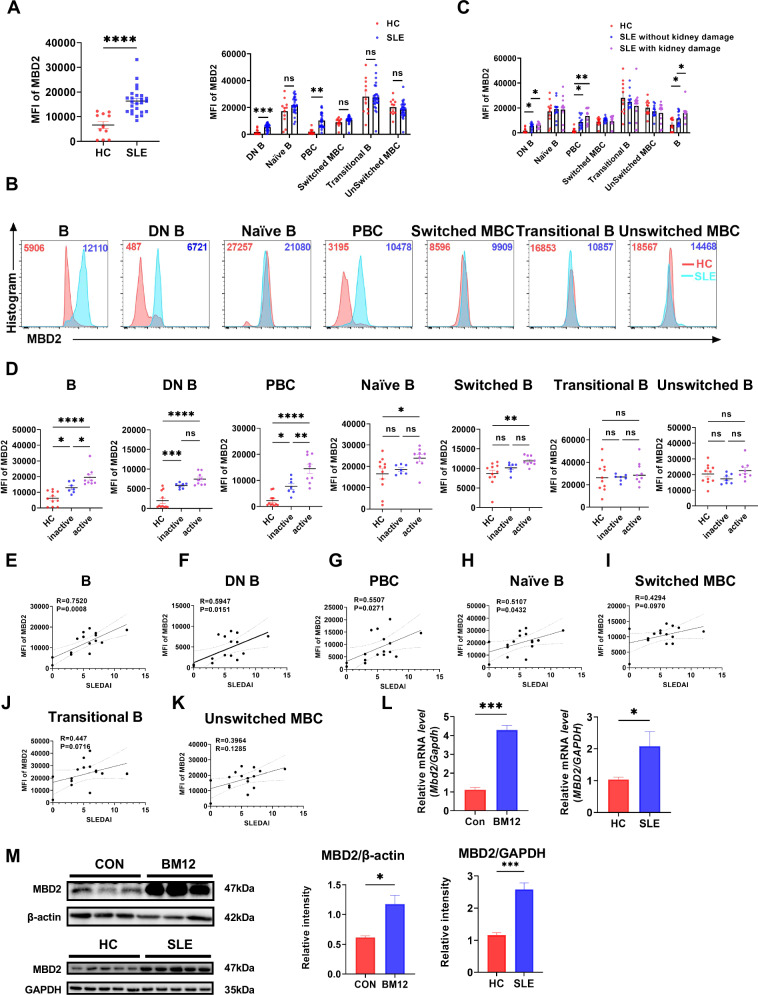
图 1. MBD2在SLE患者B细胞中的表达增加并与疾病活动性相关
MBD2在SLE患者B细胞中的表达水平显著高于健康对照组,尤其是在双阴性B细胞和浆母细胞中。MBD2的表达水平与SLE疾病活动性(SLEDAI)呈正相关,且在有肾脏损伤的SLE患者中表达更高。这些发现表明MBD2可能在SLE的发病机制中起重要作用,尤其是在B细胞的异常激活和分化过程中。
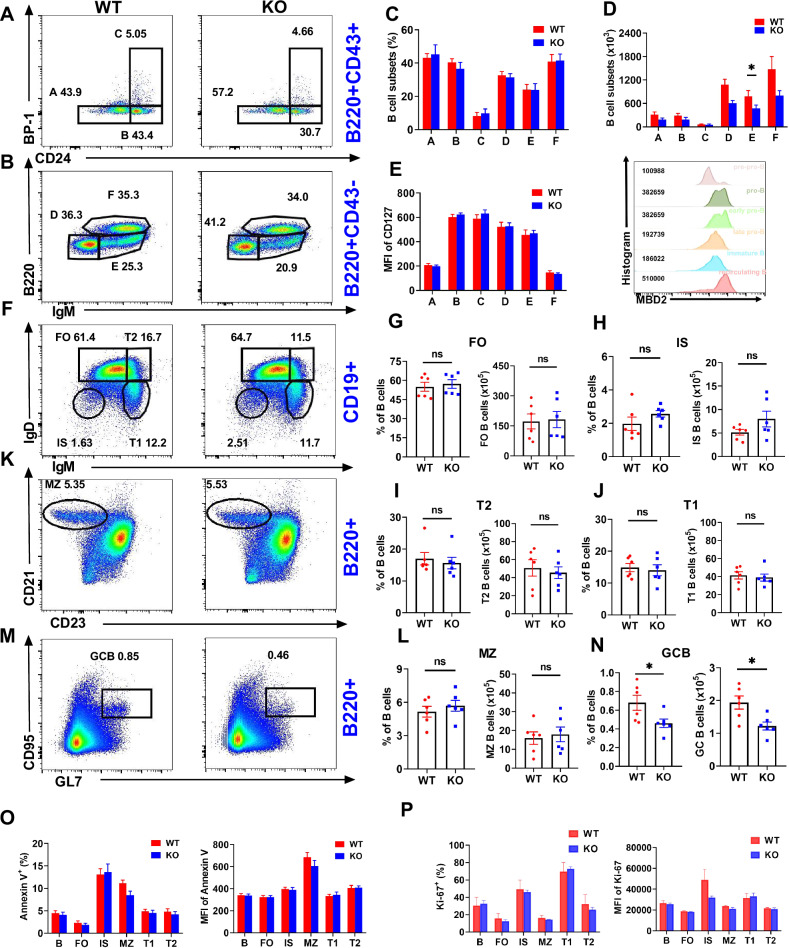
图 2. MBD2缺失破坏B细胞分化和生发中心形成
研究者确定了MBD2缺失(KO)对小鼠B细胞分化和生发中心(GC)形成的影响。结果显示,MBD2缺失显著减少了脾脏中GC B细胞的数量,但对其他B细胞亚群(如滤泡B细胞、边缘区B细胞等)的影响不显著。此外,MBD2在骨髓中所有B细胞亚群中均有表达,且其缺失导致未成熟B细胞数量减少,但对B细胞的增殖和凋亡无显著影响。这些发现表明,MBD2在B细胞分化过程中,尤其是在GC B细胞的形成和维持中起着关键作用。
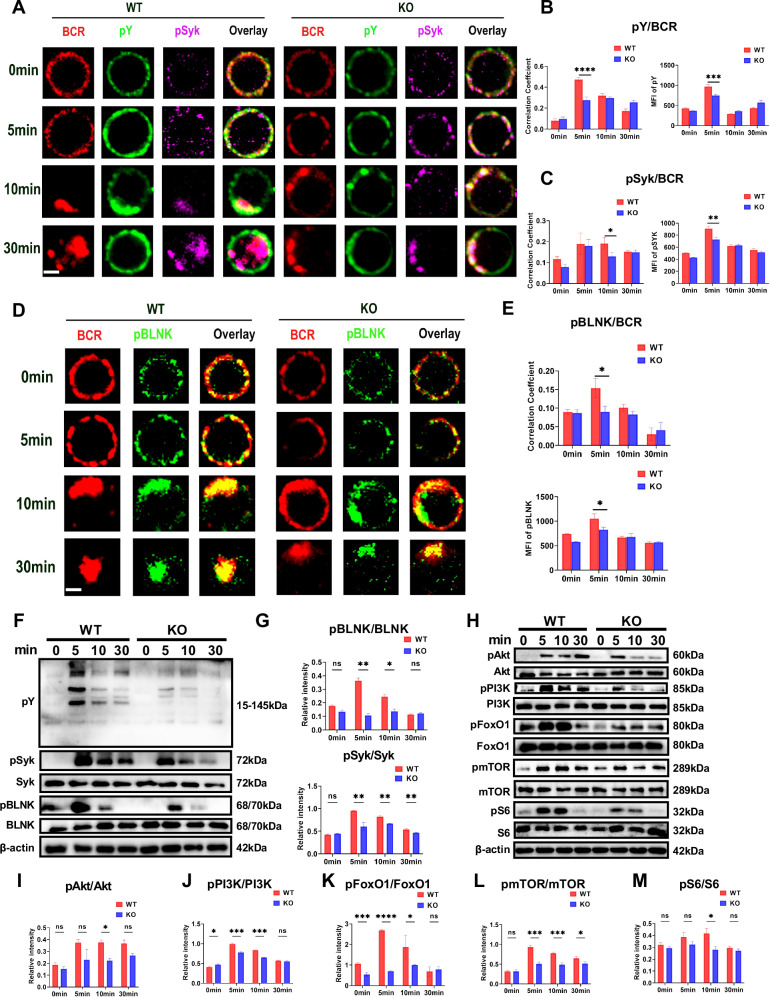
图 3. MBD2缺失削弱B细胞激活和BCR信号传导
与野生型(WT)小鼠相比,MBD2缺失小鼠的B细胞在BCR刺激后表现出信号复合体转位延迟、磷酸化蛋白(如pY、pSyk、pBLNK)水平降低以及PI3K-Akt-mTOR信号通路的抑制。这些发现表明MBD2在B细胞激活和BCR信号传导中起关键作用,其缺失会显著削弱B细胞的信号传导能力,进而影响B细胞的激活和功能。
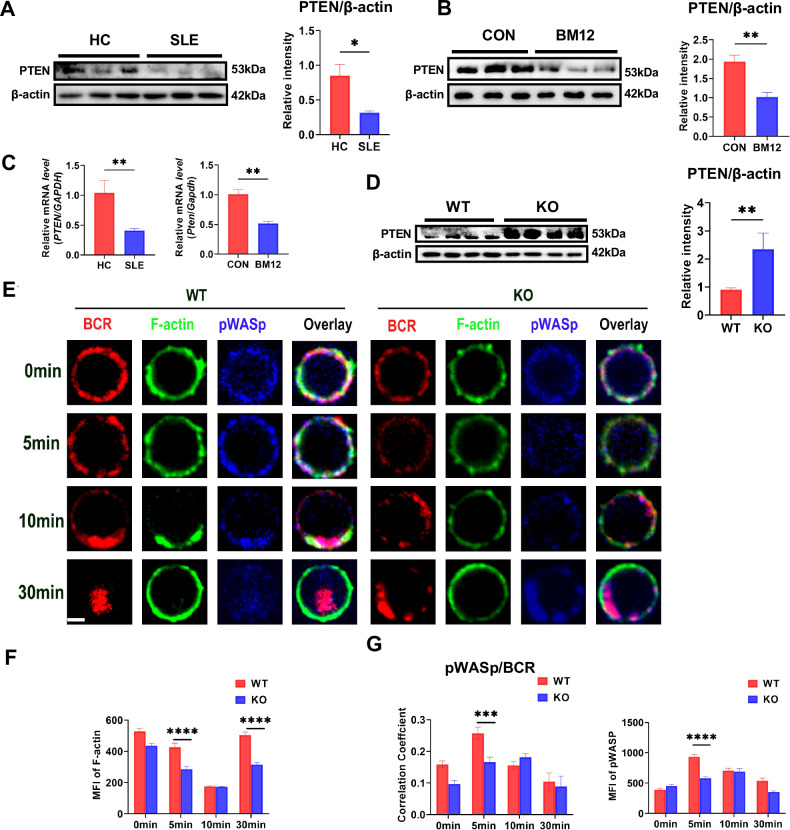
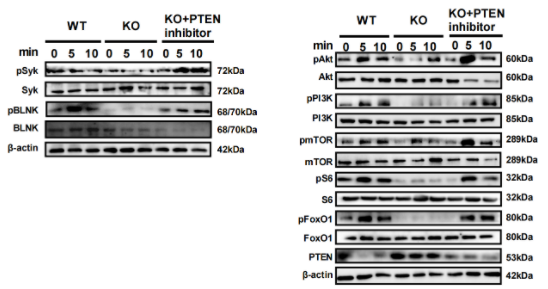
图 4. MBD2缺失通过上调PTEN表达削弱B细胞激活和BCR信号传导
与野生型(WT)小鼠相比,MBD2缺失小鼠的B细胞中PTEN表达显著增加,而PTEN的上调抑制了PI3K-Akt-mTOR信号通路,削弱了B细胞的激活和BCR信号传导。此外,PTEN的增加还抑制了细胞骨架的重组和BCR微簇的聚集。使用PTEN抑制剂BpV(购买于AmBeed)可以恢复受损的BCR信号传导,表明MBD2通过抑制PTEN促进B细胞的激活和功能。
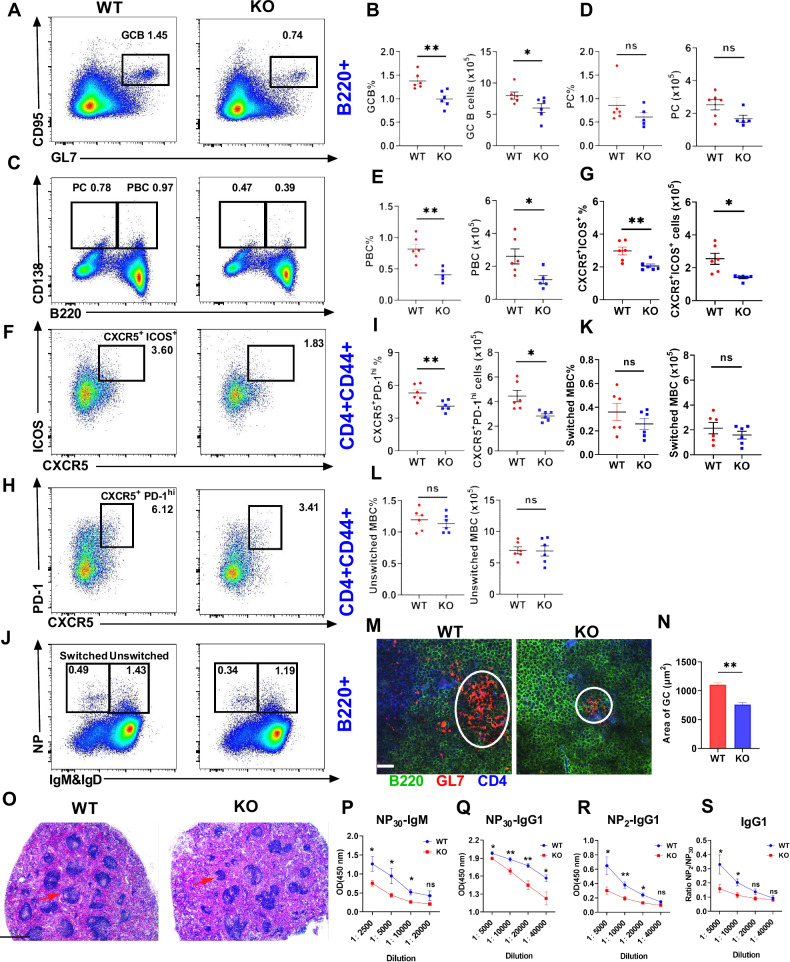
图 5. MBD2缺失减弱T细胞依赖性免疫反应
与野生型(WT)小鼠相比,MBD2缺失小鼠的脾脏中生发中心(GC)B细胞、浆细胞(PC)、浆母细胞(PBC)和T滤泡辅助细胞(Tfh)的数量显著减少,脾脏滤泡结构受损,且血清中NP特异性IgM和IgG1抗体水平降低,抗体亲和力受损。这些发现表明MBD2在GC形成、B细胞分化和高亲和力抗体产生中起关键作用。
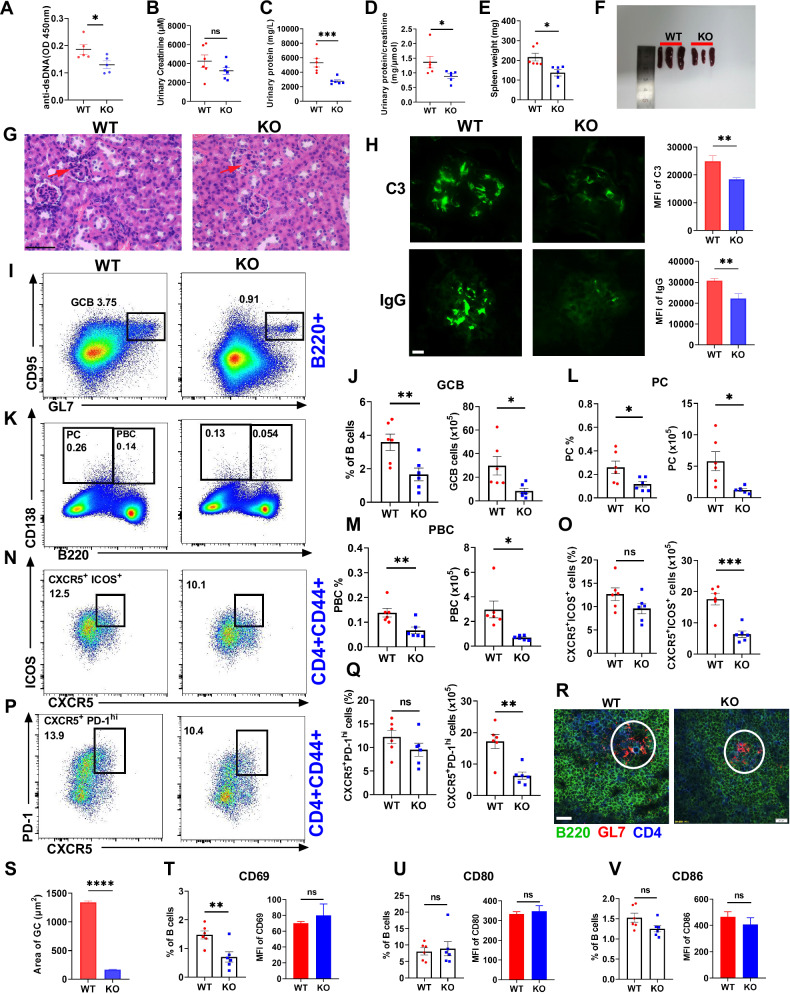
图 6. MBD2缺失改善cGVHD模型中的狼疮样自身免疫和肾脏损伤
通过ELISA、尿液分析、脾脏和肾脏的组织学检测以及流式细胞术等方法,研究了MBD2缺失(KO)对小鼠系统性红斑狼疮(SLE)模型(cGVHD模型)的影响。结果显示,与野生型(WT)小鼠相比,MBD2缺失小鼠表现出抗dsDNA抗体水平降低、肾脏损伤减轻(尿蛋白减少、肾小球细胞浸润减少、免疫复合物沉积减少)、脾脏肿大减轻以及生发中心(GC)B细胞、浆细胞(PC)、浆母细胞(PBC)和T滤泡辅助细胞(Tfh)数量减少。这些发现表明MBD2缺失显著减轻了SLE模型小鼠的疾病症状,揭示了MBD2在SLE发病机制中的关键作用。
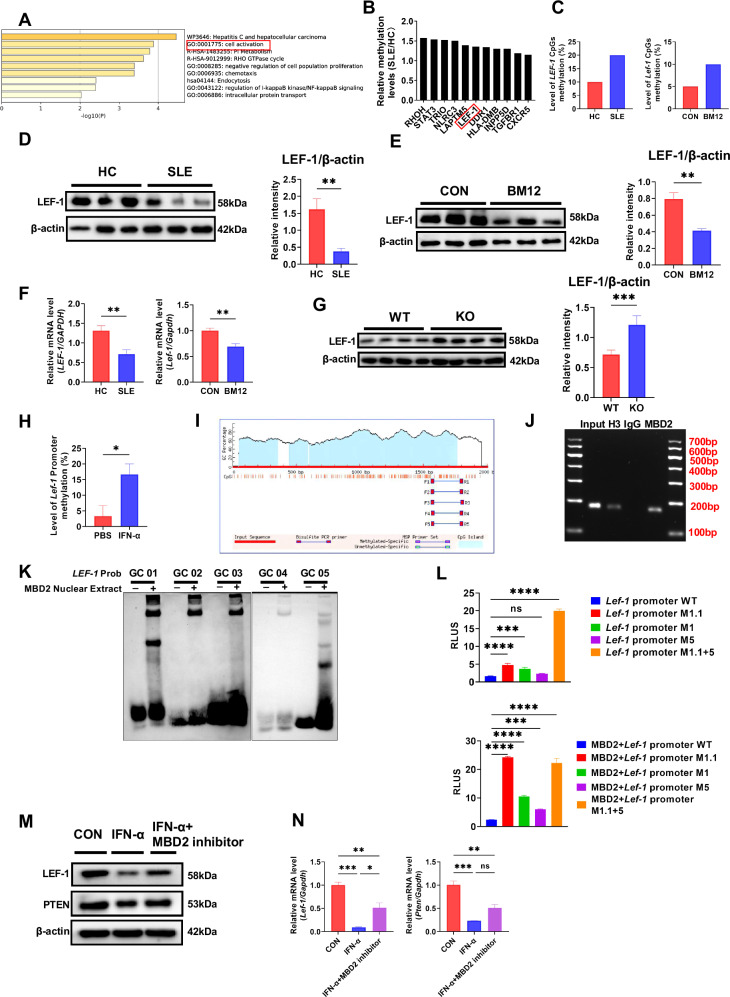
图 7. MBD2通过抑制LEF-1转录调节SLE中的B细胞激活和BCR信号传导
研究发现,MBD2能够结合LEF-1启动子区域的甲基化CpG位点,抑制LEF-1的转录和表达,进而影响PTEN的表达。IFN-α通过增加LEF-1启动子的甲基化水平,进一步抑制LEF-1和PTEN的表达,从而促进SLE的发病机制。MBD2的缺失导致LEF-1表达上调,进而影响PTEN的表达,揭示了MBD2在SLE中通过调控LEF-1-PTEN轴影响B细胞激活和BCR信号传导的分子机制。
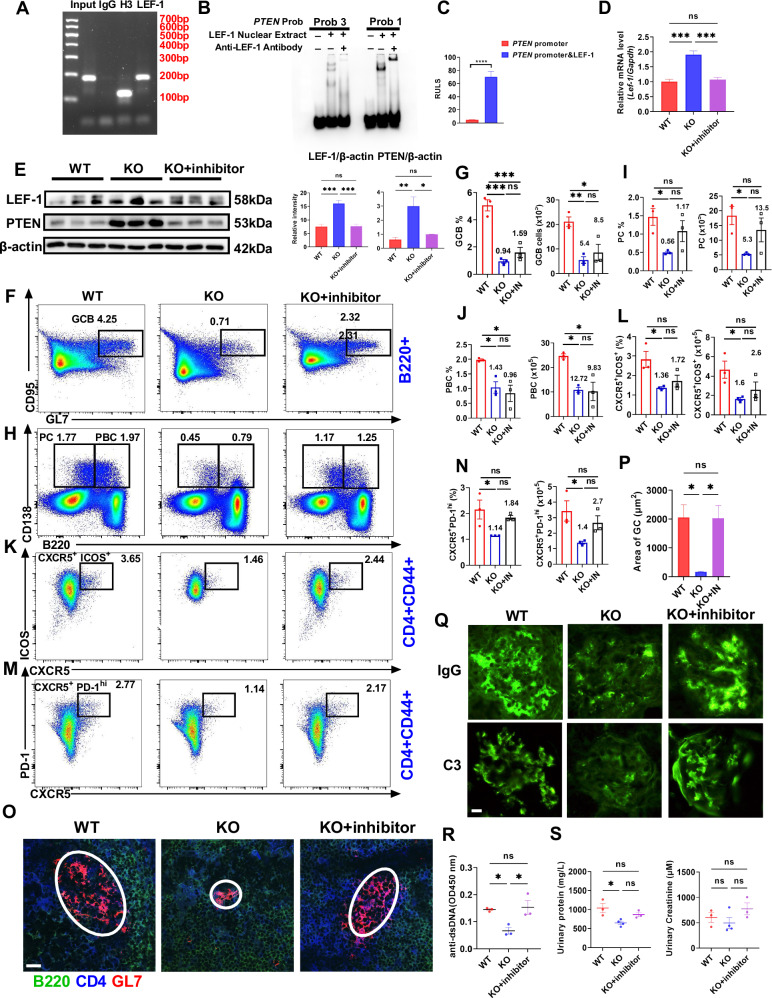
图 8. MBD2通过抑制Lef-1转录调节PTEN表达
研究者通过相关实验验证了LEF-1对PTEN表达的正向调控作用,并探讨了LEF-1抑制剂对MBD2基因敲除(KO)小鼠在系统性红斑狼疮(SLE)模型(cGVHD模型)中的影响。结果表明,LEF-1能够结合PTEN启动子并促进其转录活性。在KO小鼠中,LEF-1抑制剂处理降低了LEF-1和PTEN的表达水平,部分恢复了GC B细胞、PC、PBC和Tfh细胞的比例和数量,但同时加重了肾脏病理损伤和抗dsDNA抗体水平,表明LEF-1在SLE发病机制中起重要作用,其抑制可能加重疾病症状。
研究结论
这篇文章通过一系列实验揭示了MBD2在系统性红斑狼疮(SLE)中的关键作用。研究发现,MBD2在SLE患者B细胞中高表达,并与疾病活动性正相关。MBD2通过结合LEF-1启动子区域的甲基化CpG位点,抑制LEF-1的转录和表达,进而影响PTEN的表达,激活PI3K-Akt-mTOR信号通路,促进B细胞的激活和分化。在MBD2基因敲除(KO)小鼠中,观察到生发中心(GC)B细胞和浆细胞(PC)数量减少,抗体分泌降低,以及在cGVHD模型中狼疮样症状的显著减轻。这些结果表明MBD2在SLE的发病机制中起重要作用,为SLE的治疗提供了新的潜在靶点。
DOI: 10.1038/s41419-025-07750-6













